【実験プロトコール】Western Blotting
本日からWestern Blotting=ウェスタンブロットに関する記事を複数回に分けて書いていきます。Western Blottingとはタンパク質検出の方法です。
まずプロトコール概要について、次に各ステップの意義、用いる試薬の役割、Tipsや調べたことなど書けたらと思います。
なかなかのボリュームなので、何回になるか分かりませんが…。
Wester Blottingについてはいくつか他の記事もあります。
ウェスタンブロッティングのトラブルシューティング:非特異バンドが多すぎるとき① - こりんの基礎医学研究日記
ウェスタンブロッティングのトラブルシューティング:非特異バンドが多すぎるとき② - こりんの基礎医学研究日記
ウェスタンブロッティングのトラブルシューティング:1次抗体と2次抗体を変えてみる。 - こりんの基礎医学研究日記
ウェスタンブロッティング:新しい抗体 - こりんの基礎医学研究日記
*****************************************
まずは大まかなプロトコールです。おそらく用いる検体や器具によって、ラボによって、違いが出てくると思いますが、私が先輩に教えてもらい、いつも行っている方法について記載します。
※20.5.18写真をいくつか追加しました。
- 【準備】ウェスタンブロットで解析したい細胞を2x10^5個/tubeとなるようにスクリューキャップ付き1.5mlチューブに入れ、遠心 1200rpm 3min
→上清を吸引してペレットのみとする。(用いる細胞にもよるがおそらくペレットは視認できず。)
※この状態で凍結保存(-30℃)可能。室温にて回答したのちに、2.から実験再開可能。
※細胞数は多すぎても少なすぎても望ましくない。
※サンプル調整に関しては別記事あり↓
- 【サンプル調整①】まずサンプルバッファーを作成。当ラボではBIO RAD 4x Sample bufferを使用しているため、これをMilli Q waterで4倍に希釈し1xとする。
(2x Sample bufferも市販されているようなので、用いるものに応じて適切に希釈する。)
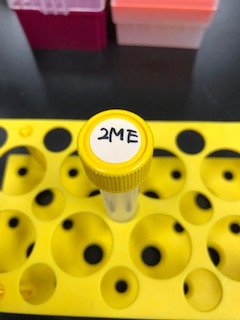
1xとしたものに2%となるように2MEを加える。
具体的には、以下のように行う。
1x Sample buffer 98μl
2ME 2μl
これで2MEが2%となる。 - 【サンプル調整②】上記で作成した溶液30μlをペレットだけが残っている各チューブに入れ、ピペッティング懸濁する。
→このとき粘性が生じることがあり、この粘性は細胞数が多すぎるサインだと教わりましたが、経験的にこのあと希釈すれば問題なく結果は出るかと思います。
※2MEには刺激臭がある。
※Sample bufferは室温保存、2MEは4℃保存。
※BCA法でタンパク量を測定するときには2MEは入れない。(筆者はBCA法をやったことがないので詳しくは不明。)

- 【サンプル調整③】ヒートブロックにて加熱。95℃ 5min
- 【サンプル調整④】遠心 1500rpm 5min
- 【サンプル調整⑤】上清を使用する。吸引して新たな1.5mlチューブに入れる。
※ここで必要に応じて1xSample bufferを用いてサンプルを希釈する。例えば2倍希釈や5倍希釈など(これは実験結果を見ながらtry & errorで調整していくほかないような気がします。筆者としては初回はとりあえず希釈なしでやるほかないのでは…と思っています。) - 【泳動①】まず使用するものの準備です。
Running buffer:自作する方法もありますが(別記事で紹介予定)、私は市販のものを使用しています。Tris-Glycine-SDS buffer 10xというものです。10xなので、10倍に希釈します。
具体的には、1L必要なので、以下のようになります。
Tris-Glycine-SDS buffer 10x 100ml
Milli Q Water 900ml
↓これがいつも使っているRunnnig bufferです。Milli Qで10倍に希釈して使っています。
Gel:Gelは流すもの(分子量などを参考に)に応じて決めますが、私は4-20%Gelを用いることが多く、だいたいこれでうまくいっている印象です。

何度やってもなぜか写真がさかさまになってしまいます。。すみません。。
まず、上記のパッケージを開け、上部についている櫛(くし)状のコームを外す。その後に底面に貼られているシールを剥がす。※シールを剥がさないと、電気が流れず泳動ができないので注意!! - 【泳動②】Gelを専用の器具ではさみ、泳動槽にセットする。泳動槽にラインが引いてあるので、その位置に合わせてrunning bufferを入れる。Gelの底面に気泡が入らないように注意しながら入れていく(斜めにしながら入れるとよい)。気泡が入ってしまった場合は先の曲がった針を用いるなどして気泡を取り除く。気泡がある部分には電気が流れないので注意!!また針とシリンジを用いてwellのひとつひとつにrunning butterを入れていく。

↑上から
↑前から
↑ピンク矢印のところに気泡がたまっているのが分かるでしょうか。これだと気泡部分に電気が流れなくなってしまいます。
↓上の写真を絵で示したものです。気泡が底にたまってしまったときの除去法(例)
↓以下のように針先を曲げた注射器を使って気泡を飛ばす(?)ような感じです。
- 【泳動③】各wellにマーカーとサンプルを入れていく。Gelが入っていたパッケージに何μlまで入れられるか記載されているので、それを参考に入れていく。サンプル数にもよるが、Gelの両端の列は空くようにすると良い。(サンプルは真ん中に集中するように入れていくと良い。)
↑マーカー
- 【泳動④】準備が終わったら営業電気泳動スタート。
80V 5min → 200V 40min
※30分ほど経った時点で確認しサンプルがGelの底面に近くなっていたら、その時点で終了するか35分程度で終了するなど適宜調整する。
※泳動に関しては別記事あり↓
- 【blotting①】上記の泳動中にblottingの準備をする。必要なものは以下の通り。
1) Transfer buffer
Tris 3g, Glycine 14.4g, メタノール200mlをMilli Q waterに溶かして合計1000mlとなるようにする。(Milli Q waterだけだとだいたい780mlくらい)
2) Membrane
Membraneだけとり出したら、メタノール数mlに数秒から数十秒程度浮かせてから、transfer bufferに浸し、gentle agitationする↓


3) ろ紙4枚(隙間が無くなるように。厚さによっては2-6枚と適宜増減。)
4) スポンジ2枚
5) Blotting水槽
1)のTransfer bufferを作ったら、以下の写真のように↓ ろ紙、スポンジ、Membraneを挟む用の板をTransfer bufferにしばらく浸しておく。

- 【blotting②】泳動が終わったら、Gel板を泳動槽から取り出し、コテなどを用いて透明の板をはがし、中に挟まれているGelのみを取り出す。
→1分程度transfer bufferに浸す。次のように↓ Gelとmenbraneを挟み、Blotting槽にセットする。
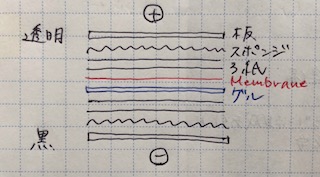
Gel内のタンパク質は負に帯電しており、陽極側に引かれていくので、Gelの陽極側にmembraneを置く。
→100V 60min
↑blotting中
※Blottingに関しては別記事あり。
- 【blocking】上記のblotting中に、blocking溶液を準備しておく。これに関しては別記事あり。筆者blocking剤として現在はスキムミルクを使用中。
ウェスタンブロッティングのトラブルシューティング:非特異バンドが多すぎるとき② - こりんの基礎医学研究日記
※この工程により、目的以外のタンパク質に抗体が結合するのを防ぐ。(ブロックする。)
blottingが終了したら、membraneを挟んでいる板を外しmembraneを取り出し、membraneにマーカーが移っていることを確認する。(バンドの位置がわからなくならないように、鉛筆で印をつけておくのも良い。)membraneを乾かさないように、すぐに用意しておいたblocking溶液に浸し、以下のように振とうしながら室温で1時間置く。
- 【抗体反応①】まず1次抗体を準備する。使用する抗体の添付文書などを参考にしながら、適宜希釈をする。今回の場合は1:500で希釈をする場合を考える。以下のような組成で1次抗体溶液を作成する。
PBST(500mlPBSにTween500μlを入れたもの) 6ml
1次抗体 3μl
※抗体は非常に高価なため、使用料ができるだけ少なくなるように工夫する。今回の場合は、最終の総量が6mlになるように1次抗体溶液を作成する。抗体の希釈溶液としては、washingにも用いるPBSTを使用した。 - 【抗体反応②】blockingが終了したら、以下のようにビニールの中にmembraneと1次抗体溶液を入れ、パッキングする。このようにすることで、少ない抗体量でもmembrane全体を溶液に浸すことができ、1次抗体反応が可能となる。密閉する際に、空気を少量含ませる場合と全く含ませない場合があるが、写真は含ませていない場合を示しています。gentle agitation, 室温20-30min
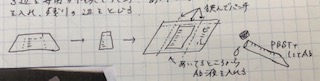

- 【抗体反応③washing】指定の時間が終わったら、上記のビニールパックをハサミで切って開け、中のMembraneを取り出し、PBSTを適当な量入れたタッパーなどの容器に浸し1次抗体を洗い流す。gentle agitation, 室温5min →これを2回(計10分)
- 【抗体反応③】Washing中に2次抗体溶液を作る。1次抗体と同じように適宜希釈する。今回の場合は、2次抗体を10,000倍希釈して使う場合を考える。以下のように希釈する。
PBST 10ml
2次抗体 1μl
今回の場合は、希釈率が高く、総量も10mlと多いため、1次抗体のときのようにパッキングする必要はないため、タッパーなどの容器にそのまま浸す。
Washing終了後、Membraneを2次抗体溶液とともに容器に入れる。gentle agitation, 室温20-30min - 【抗体反応③washing】指定の時間が終わったら、再びPBSTを用いてwashingを行う。この時のwashingはしっかり行う必要がある!!様々なwashing手順がネット、書籍などで示されているが、今回はその一例。
5min x2回 →30min x1回 →2hx1回 →5mlx2回 いずれもgentle agitation, 室温
or
4℃ over night - 【検出】当ラボではMILLIPOREを使用。

上記の中に入っている2種類のsolutionを1:1で混合し(例えば1ml+1ml)、その混合液にMembraneを浸す。1分程度浸した後に、ラップやビニールフィルムなどで空気が入らないように包み、検出器へ。

終了!!
今後、各ステップについての詳細を書ければ書きたいと思います。