ノーベル賞を受賞した遺伝子編集技術CRISPR/Cas9と異なるアプローチで遺伝子発現を調節するCRISPR offシステムについて、抄読会で扱いましたので紹介します。タイトルは「CRISPR offシステム」としていますが、自分の勉強のため、背景などの説明が主になります。実際に発表された論文の内容はだいぶ後半です。
まず、CRISPR/Cas9やその他のゲノム編集技術について説明していきます。
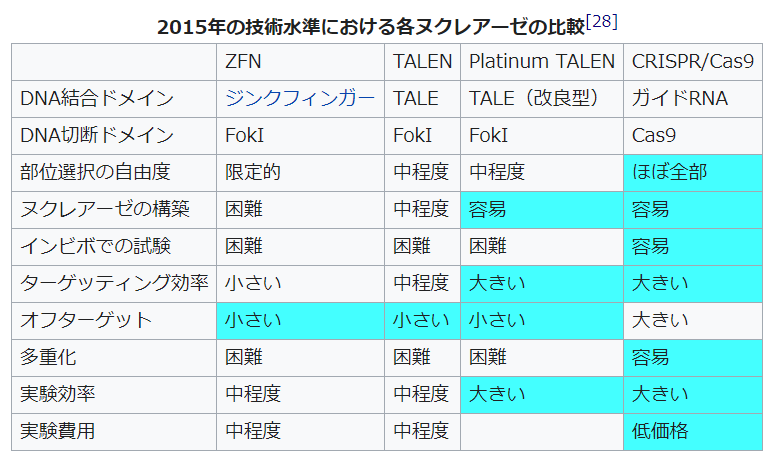
過去のゲノム編集は効率が非常に悪く、狙った編集が成功する確率がとても低い状態でした。1990年代~2000年代にかけてZFN、TALENなどの技術が開発されました。これに加え、2012年にCRISPR/Cas9システムが発表されてから、ゲノム編集は大きく発展した。
CRISPR/Cas9の原理については以下の通り↓
もともとは細菌や古細菌の防御システムでした。
例えば大腸菌とかの中ウイルスが入ってきて、そのウイルスは自分のDNAを大腸菌の中に組み込もうとします。そうすると大腸菌がこのCRISPR-Cas9システム使って自分のものではないDNAを切り取るのです。(適応免疫防御機構)
CRISPR-Cas9システムは、
①ガイドRNA
②Cas9タンパク質(エンドヌクレアーゼ)
③PAM配列
の3つの要素で構成されています。
菌(ヒトでも動物でもなんでも可)のDNAの中の、「ガイドRNAと相補的な配列」でありなおかつ「PAM配列のすぐ上流に位置する配列」という2つを満たす場所(配列)にガイドRNAがCas9を連れて行き、Cas9がそこに到着すると問題のDNAをカットします。
カットされた後は、細胞の修復機構によって修復され、この修復の際に、カットされた部分に別の遺伝子を入れることもできます。
CRISPR-Cas9以前にもゲノム編集はありましたが、CRISPR-Cas9は時間やお金がこれまでの方法よりかからず、簡単にできるという点が優れていました。
出典:
CRISPR-Cas9システムとゲノム編集 - こりんの基礎医学研究日記
ZFN: Zinc-Finger Nuclease
TALEN: Transcription Activator-Like Effector Nuclease
 出典:Wikipedia
出典:Wikipedia
上図を見るとわかるように、それまでの方法のZFNやTALENと比べるとメリットが多いことが分かる。この中でも特に、操作が簡便でかかる時間と労力が大きく減少したという点が大きい。TALENなどは技術が特殊なので、やっている施設や機関に編集を依頼して何週間もかかるような状況だったが、CRSPERは簡単な操作でできるので、どこの研究室でも短時間で可能になりました。それに伴い費用も大きく抑えられました。
しかしデメリットもあります。まずTALENなどほかの方法と比較すると特異性が低くオフターゲット変異が多いという特徴があります。つまり目的以外の遺伝子にも改変が起きてしまうということです。
CRISPRでは意図的にDNAの二重螺旋を切断することから、細胞の予期しない免疫反応を引き起こしたり、ターゲット遺伝子以外の遺伝子を変更してしまったりするオフターゲットと呼ばれる現象が稀に引き起こされる。特にゲノム編集技術を人間の治療に適用しようとする場合には、オフターゲットを引き起こさないことが必須条件となる。
出典:「CRISPRフリーのゲノム編集時代の幕開け―ゲノム編集技術の展開―」
三井物産戦略研究所 技術フォーサイトセンター 兼 技術・イノベーション情報部インダストリーイノベーション室 阿部 裕
そしてこのCRISPR/Cas9システムの対抗馬として現れたのが今回紹介する文献です。
その名もCRISPR offです。長い文献なのでかいつまんでいきます。
Nuñez JK, et al.
Genome-wide programmable transcriptional memory by CRISPR-based epigenome editing.
Cell. 2021 Apr 29;184(9):2503-2519.e17.
ここでまだ背景説明が続きます。DNAメチル化についてです。
DNAメチル化(ディーエヌエイメチルか)とは、DNA中の塩基の炭素原子にメチル基修飾が付加される化学反応である。

出典:Wikipedia
このメチル化がなんなのかというと、ざっくり言いますと
DNA上にある遺伝子の発現を制御する領域(プロモーター)が
メチル化される→遺伝子発現がOffに
…これを担っているのはDNAメチル化酵素DNMT3AとDNMT3B
脱メチル化される→遺伝子発現がOnに
....これを担っているのはTet1,2,3などのTetファミリー
DNAメチル化は通常CpG(英語版)ジヌクレオチド部位(シトシン-ホスホジエステル結合-グアニン)で起こる。
(中略)ほ乳類で全てのCpG部位の60-90%はメチル化されている。
出典:Wikipedia
→つまりCRISPR/Cas9システムで遺伝子を書き換えなくてもメチル化を調節することで遺伝子発現をコントロールすることができる(これによってCRISPRに対抗する)という内容です。
彼らのチームは、DNA鎖の特定の場所をメチル化できるCas9融合たんぱく質を開発しました。これによってメチル化された遺伝子はOffになり、このメチル化は非常に特異的です。
CRISPR/Cas9システムの弱点であった特異性の低さ(オフターゲット変異が起きてしまう)を解決していることになります。
また、Offにするだけでなく単一ガイドRNAとMS2コートタンパク質で構成されるCRISPR Onシステムにより、脱メチル化を起こさせ、目的遺伝子の発現をOnにすることもできます。
また他の優れた点としては、以下のようなものが挙げられます。
- 数百回細胞が分裂してもこのたんぱく質の機能は保持される
→細胞分裂しても遺伝子発現のOn/Offは受け継がれる。
- CpGアイランドを含まないほとんどの遺伝子で利用可能。
- iPS細胞にメチル化/脱メチル化を施した場合、分化してもこの機能は保持される。
最後の実験は、このCRISPR Off/Onシステムの実用性を検証するために追加されました。筆者らはCRISPR Offシステムを利用し、iPS細胞の特定の遺伝子をサイレンシングし、その後ニューロンへと誘導させました。ニューロン誘導後も90%の遺伝子はサイレンシングを保持しており、細胞型が変更してもなおCRISPR Offによる変更を保持しているというこが分かりました。
CRISPR/Cas9システムが2020年にノーベル賞を受賞したばかりですが、また新しい技術が出てきました。個人的には遺伝子を書き換える必要がない(遺伝子を傷つけない)という点だこちらの方法は優れているように思います。またCRISPRベースの新しい技術がどんどん出てくるかもしれませんが置いてかれないようにしなければなりません。

 出典:
出典: