【文献紹介】造血幹細胞のex vivo増殖に関するレビュー
本日からまた新たな文献紹介です。何回かに分けることがこれまでは多かったですが、今回は本日だけで全部紹介します。長いですが…もう少し要約力をつけらるよう努力したいと思います。
Cells. 2019 Feb; 8(2): 169.
Ex Vivo Expansion of Hematopoietic Stem Cells for Therapeutic Purposes: Lessons from Development and the Niche
Parisa Tajer, Karin Pike-Overzet, Sagrario Arias, Menzo Havenga, and Frank J.T. staal
1.Introduction
多分化能と自己複製能を有する造血幹細胞(HSC)は、移植治療の魅力的なソースであるが、患者やドナーから採取できるHSCの数は限られており、これが幅広い移植応用の障壁となっている。
HSCの静止(生体内でHSCの多くは静止期にある)、自己複製、分化は、微小環境(ニッチ)により外因子と幹細胞内の内因子によって制御されており、この仕組みをよりよく理解することでHSCのex vivoで増殖させる方法の確立につながり、ひいては幅広い移植治療への応用につながる。
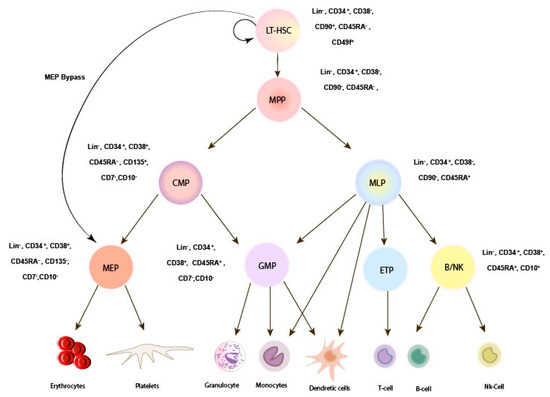
2.血液の階層性分化
血液細胞はHSCを最上流とした階層型の分化様式をとっている。
HSC: 造血幹細胞→主にshort-term HSCやMPPsへ。
multipotent progenitors (MPPs): 多能性前駆細胞
lineage-committed progenitors of common lymphoid (CLP): リンパ系共通前駆細胞
common myeloid progenitors (CMP): 骨髄系共通前駆細胞
granulocyte/monocyte progenitors (GMP): 顆粒球・単球系前駆細胞
megakaryocyte/erythrocyte progenitors (MEP):血小板・赤血球系前駆細胞
近年の研究では様々なことが分かってきている。
・single cell RNA sequenceにてHSCと巨核球の特徴が類似していることが示された。
・前駆細胞クラスは胎生から成体にかけて変化がある。
・巨核球はCMPをバイパスしHSCから直接分化できる可能性がある。
・血小板偏向HSCが存在している可能性がある。
・造血幹細胞の中には自己複製能を持ちながら分化能が骨髄球系のみに限定されている骨髄球系前駆細胞myeloid-restricted repopulation progenitors (MyRPs)が存在している。
フローサイトメトリー(FACS)の開発によってHSCや前駆細胞を表面マーカーで区別できるようになってきた。例えばCD34, 38, 90, 45RAなどはin vivoでもin vitroでもHSCと前駆細胞を区別するマーカーとして有名。Single cell RNA sequencingとともに造血機能のメカニズム解明に役立っている。
3.HSCの自己複製制御とニッチ
HSCの自己複製能の制御がどのように行われているかは、造血研究分野における重要な課題である。転写因子やエピジェネティック修飾因子のほかニッチと呼ばれる微小環境(外因子)によって調整されている。
ニッチとは…造血幹細胞運命、増殖率を決定し、細胞を枯渇や細胞死から守るための、特殊な厳格に制限された環境。
(マウスでは研究が進んでいるがヒトではまだ…材料の少なさや倫理的問題から)
HSCは発達段階の様々な段階で出現: 大動脈生殖腺中腎領域AGM→胎児肝FL→骨髄BM
・HSCの多くは静止期(自己複製と分化を制限しプールサイズをコントロールしている。
・ストレスにより一時的に脾臓や肝臓に部分的に造血が移行することも。
・骨髄部位によって自己複製能は異なるとの報告も。
・静止期HSCは、骨髄中でも血管周囲間質細胞と臍動脈の近くにあり、酸素濃度が低い。→加齢によって場所は変化右するかも?
→ニッチ構造は不均一。
・近年では、ハイドロゲルを用い、生体内を模倣した3Dモデルも開発されている。in vitroでニッチ環境を再現でき、in vitroでのHSCコントロールに役立つ可能性がある。
4.HSCにおけるWntシグナル
Wnt毛色は成体におけるHSC自己複製、胎児造血においてとても重要。(カノニカル経路と非カノニカル経路の2種類の経路が提唱されている。)→どちらにしても胚発生、幹細胞維持や恒常性に関与。
→HSCのex vivo増殖に利用できるかもしれない。
例えば…
・非標準経路(非カノニカル)経路で重要なwnt5を用いてマウスHSCをex vivoで増殖する方法が報告されている。
・標準経路(カノニカル経路)において重要な役割を果たすβカテニンの安定性にprostaglandin E2 (PGE2)が関与→PGE2をex vivo増殖に使えるのでは?
Wnt機能は容量依存性であり、HSC内に多すぎると枯渇につながる(少ないと未成熟細胞を維持でき長期再増殖能につながる)。増えすぎないよう、ニッチから厳格に制限を受けている。
5.HSCにおけるNotchシグナル
Wntと同じく細胞運命決定や発達に重要な経路。その役割はまだ議論の余地あり。
・マウスでは…胎生期の初期造血には重要(血管循環器系の発達を促進することでHSC発生を促進)。しかし成長とともにその活性は下がり、成体骨髄でのHSC維持には不要。
・Notchシグナル伝達は、細胞間相互作用(Notch受容体と膜貫通型リガンド(DeltaとJaggedがある)のやりとり)に基づいている。
・HSCにおけるNotch遺伝子や受容体の過剰発現は、機能的HSCの数の増加、自己複製能の増加、分化阻害につながる。しかしNotchをノックアウトしても自己複製には影響なし!
・ニッチシグナルはNotchシグナルの活性化に関与。またNotch1やJagged1の遺伝子変異マウスでは胚性致死や造血障害が生じるのに対してNotch2,3,4ノックアウトでは造血障害は確認されず…胚発生においてNotchは不可欠だが成体造血における役割はまだ明らかでない。
・Wntシグナルとのクロストークあり!
6.HSCのEx vivo増殖
HSCは移植などの治療に利用されるが、患者やドナーから得られるHSCは数が限られているため、臨床応用のためにその生体外での培養・増殖が重要になってくる。
HSCは、生体内で対象分裂と非対象分裂をする。→これはニッチによってコントロールされている。(ニッチが自己複製と分化を決めている。)
→Ex vivo増殖のためには…分化を伴わず自己複製能を有したままの対象分裂が必要!
→このために様々なサイトカインや成長因子が研究されている。
・SCF, Flt3, TPO, IL-3, IL-6などが、in vitroにおけるHSCと前駆細胞の生存・増殖・維持に一般的に使用されている。
・サイトカインの系統分化や自己複製への関与は長年研究されてきた。上記に挙げたサイトカインカクテルは4日程度の短期HSC増殖にしか役立たないのでは…などと報告されている。→サイトカインベースだけの培養は難しい。他の因子が必要!
・その後の研究で様々な分子がスクリーニングされた結果、Prostaglandin E2 (PGE2), Stemregenin 1 (SR1) (an Aryl hydrocarbon receptor antagonist), UM171などがin vitroでのHSC培養に役立つ可能性があるとしてピックアップされた。
・PGE2: 臨床試験の結果、ex vivo増殖には関与せず。
しかし臍帯血移植の生着率向上やウイルス形質導入には役立つ可能性あり。
→長期培養中の不要な分化を防ぐ、コストカットに役立つかも。
・SR1: マウスでもヒトでもCD34+細胞のin vitro増殖をサポート。
長期再増殖細胞よりは多能性前駆細胞や赤血球/巨核球系細胞の増殖に
役立つ?
・UM171: ex vivo増殖の有望な候補。既に同種造血幹細胞移植における
赤血球/巨核球系細胞増殖を抑える効果があるが、SR1によって相殺可能。
またHSCへの形質導入率を上げるとの報告も。
7.終わりに~まとめ~
・患者やドナーから得られるHSCの数は限られているため、遺伝子治療や再生医療への応用のため、HSCの体外増殖はニーズがある。WntやNotch経路、PGE2、SR-1、UM171などのタンパク質・分子を用い、最適な環境でHSCを体外増殖することがれきれば、様々な場面で役立つと考えられる。
・HSC集団はCD34+をマーカーとして濃縮が行われているが、この集団も不均一であり、他の表面抗原なども組み合わせ、より適切な、純度の高いHSC集団を同定することが重要である。
・ニッチの研究が進んでいるが、これは今後のHSCの体外増殖に役立つ可能性がある。CRISPR/CAS9システムなどを用いた遺伝子改変にHSCを今後用いればより臨床応用が広がる可能性があり、そのために安定したHSc ex vivo培養法を確立するべきである。