勉強したことのメモ。
転写・翻訳しただけではタンパク質は完成しない。
その後も様々なプロセスを経てタンパク質は機能するようになる。
出典:タンパク質の翻訳後修飾 (SBO35) (昭和大学)
このうち、タンパク質の化学構造を変化させる反応を翻訳後修飾と呼ぶ。
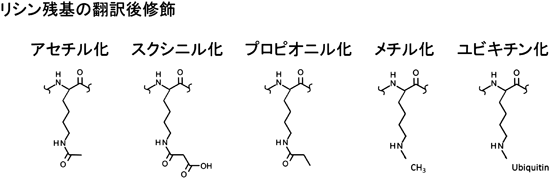
翻訳後修飾の例は以下の通り。
出典:特集「タンパク質・酵素の隠された機能について,探索とその技術」
翻訳後修飾による酵素の多機能性を探る―質量分析技術岡西 広樹,Kwang Kim
上記だけではなく、グリコシル化、リン酸化、アルキル化など300種類以上ある。
中でもリン酸化は代表的な翻訳後修飾の1つである。タンパク質が…
リン酸化:機能On
脱リン酸化:機能Off
という関係になっている。
タンパク質の約1/3がリン酸化されており、リン酸化はタンパク質を構成する次の3つのアミノ酸で起こります。
それは、セリン、トレオニン、チロシンです。
出典:Ayumi Media 「翻訳後修飾をわかりやすく説明!【糖鎖修飾とリン酸化をクローズアップ】」
出典のサイトはとても分かりやすい。
以前紹介したヒストン修飾も翻訳後修飾の1つで、アセチル化やメチル化を通して遺伝子のOn/Offを調節している。
アセチル化:遺伝子発現促進
★アセチル化:ヒストンアセチルトランスフェラーゼ (HATs)
★脱アセチル化:ヒストン脱アセチル化酵素 (HDACs)
メチル化:遺伝子発現・抑制どちらにも働く
★メチル化:ヒストンメチルトランスフェラーゼ (HMTs)
★脱メチル化:ヒストン脱メチル化酵素 (HDMs)
過去のブログ記事より
ヒストンは多くの翻訳後修飾可能な残基を持っており、特にヒストンテールのセリン、リジン、アルギニン残基などはリン酸化、アセチル化、メチル化、ユビキチン化といった化学修飾を受けることが知られている。
出典:ヒストン - 脳科学辞典
また、タンパク質のユビキチン化は分解の合図でもあり、例えば構造異常タンパク質は、ユビキチンによる修飾の後、プロテアソームの作用で分解されるという経過をたどる。
過去のブログ記事より
ユビキチンとは何かを簡単に説明しておきます。
タンパク質は必要なときに合成され、いらなくなったら分解されるというのを繰り返しています。(アミノ酸からタンパク質は作られ、またアミノ酸に戻ります。)
いらなくなったというサインを出すのがユビキチン化です。いらくなくなったタンパク質にはユビキチンが付加され、それを目印にタンパク質はプロテアソームで分解されます。